Теоретический материал по теме №3
3. Соединения углерода с кислородом
Соединения углерода с кислородом: СО и СО2. СО – угарный газ, без запаха, мало растворим в воде. Образуется при взаимодействии углерода с недостатком кислорода:
С + 0,5O2 = CO
Формально CO можно рассматривать как ангидрид муравьиной кислоты, которая легко разлагается в присутствии концентрированной серной кислоты:
HCOOH = H2O + CO
СО является несолеобразующим оксидом. Для СО наиболее характерны восстановительные свойства. Например, при комнатной температуре он восстанавливает соединения некоторых благородных металлов:
PdCl2 + CO + H2O = Pd + CO2 + 2HCl
Но в виду прочности связи в молекуле CO восстановительные свойства обычно проявляются при высокой температуре. Это свойство широко используется в металлургической промышленности для восстановления металлов из оксидов при нагревании (температуры изменяются от 300 до 1500 0С):
Fe2O3 + 3CO = 2Fe = 3CO2
В присутствии катализатора CO окисляется хлором при комнатной температуре с образованием оксодихлорида углерода (фосген):
CO + Cl2 = COCl2
При нагревании окисляется серой с образованием тиооксида углерода:
СO + S = COS,
который растворяется в воде и медленно с ней реагирует:
COS + 2H2O = H2S + H2CO3
Диоксид углерода СO2 образуется при нагревании CO с кислородом:
СО + 0,5О2 = СО2, ∆G0 = -256,9 кДж
Бесцветный газ, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. Очень много СO2 образуется при сгорании любых углеродсодержащих веществ в избытке воздуха.
При комнатной температуре и под давлением около 6000 К переходит в бесцветную жидкость. При ее охлаждении в результате испарения диоксида углерода образуется твердая снегообразная масса (сухой лед).
Орбитали углерода находятся в состоянии sp-гибридизации, поэтому молекулы CO2 имеют линейную конфигурацию: O = C = O.
В воздухе содержание CO2 составляет 0,03% (об.). Образуется при различных процессах окисления органических веществ: при дыхании живых организмов, брожения, горения топлива, горения лесов и т.д.
Диоксид углерода относится к «парниковым газам». Увеличение количества CO2 в атмосфере может привести к повышению ее температуры. Коротковолновое излучение Солнца нагревает Землю, и, как любое нагретое тело, Земля начинает излучать, но в более длинноволновом диапазоне. Ее излучение способно поглощаться молекулами CO2. В результате часть излучения не попадает в космос, а накапливается в молекулах CO2. Этим объясняется повышение температуры атмосферы, а явление в целом называется «парниковым эффектом».
Молекулы CO2 неполярны, поэтому плохо растворяются в воде – при 25 0С растворимость составляет 0,03 моль/л. При растворении CO2 в воде часть молекул взаимодействует с ней, образуя угольную кислоту: H2CO3. Молекулы угольной кислоты существуют только в растворе и не выделены в виде индивидуального вещества. Угольная кислота – слабый электролит. Кдис1 = 4∙10-7, Кдис2 = 4∙10-11.
Cоли угольной кислоты – карбонаты, мало растворимы в воде, хорошо растворимы только соли щелочных металлов и аммония. Симметричный карбонат-ион CO32- представляет собой плоский треугольник (sp2 – гибридизация атомных орбиталей углерода), устойчив к окислительно-восстановительным превращениям в щелочных средах и в виде твердых солей. При нагревании твердые карбонаты сравнительно легко разлагаются, температура разложения тем выше, чем более электроноположителен металл, образующий катион.
Температуры разложения растут в ряду:
MgCO3 (230 0С) ˂ MnCO3 ˂ FeCO3 ˂ CaCO3 ˂ SrCO3 ˂ BaCO3 (1300 0С)
Для щелочных металлов и аммония известны кислые соли – гидрокарбонаты, которые имеют более высокую растворимость, чем средние карбонаты. Большое практическое значение имеют Na2CO3 – сода и NaHCO3 – питьевая сода. Получить соды угольной кислоты можно пропусканием диоксида углерода через раствор щелочи:
CO2 + 2NaOH = Na2CO3 + H2O
В избытке углекислого газа карбонаты переходят в гидрокарбонаты:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3
В водных растворах карбонат- и гидрокарбонат-ионы подвергаются гидролизу:
CO32- + H2O ↔ HCO3- + OH-
HCO3- + H2O ↔ H2CO3 + OH-
Действие карбоната натрия или калия на растворы солей, содержащих гидролизующиеся катионы, имеющих заряд «2+» (Be2+, Mg2+, Zn2+, Co2+ и др.), приводят к образованию основных карбонатов, например, (ZnOH)2CO3. В присутствии сильных гидролизующихся катионов (Al3+, Fe3+, Cr3+) протекает реакция взаимного усиления гидролиза солей с выделением осадков гидроксидов:
2AlCl3 + 3Na2CO3 + 3H2O =↓2Al(OH)3 + 3CO2↑ + 6NaCl
Наличие гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2 объясняет жесткость природной воды. При нагревании растворов гидрокарбонатов они разлагаются на средний карбонат, диоксид углерода и воду:
Ca(HCO3)2 = СaCO3↓ + CO2 + H2O,
таким образом устраняя временную жесткость воды.
Малорастворимые соли карбонатов магния и кальция оседают на стенках котлов. Это может привести к авариям. Поэтому для устранения жесткости воды ее обрабатывают оксидом кальция CaO, который при взаимодействии с водой образует гидроксид кальция Ca(OH)2, образующий с гидрокарбонатом кальция средний карбонат. Осадок отфильтровывают:
СaO + Ca(HCO3)2 = 2СaCO3↓+ H2O
Другой способ устранения жесткости заключается в пропускании воды через колонки с катионообменными смолами для извлечения из нее ионов кальция и магния.
Соли угольной кислоты и продукты их реакции играют важную роль в кругообороте углерода в природе, а также находят широкое практическое применение. В технике и быту различают кристаллическую соду – Na2CO3∙10H2O, кальцинированную соду – Na2CO3 и пищевую соду – NaHCO3. Питьевая сода широко применяется в промышленности и в медицине. Na2CO3 является сырьем в стекольной, бумажной промышленности, текстильном производстве. Карбонат кальция СaCO3 – природный минерал (мрамор, мел, туф и др.) с давних времен применяется как строительный материал, а также в качестве связующего компонента в конструкциях. NH4HCO3 – гидрокарбонат аммония – пекарский порошок, используют в хлебопечении как разрыхлитель теста. Кроме солей угольной кислоты практическое значение имеют амиды угольной кислоты: мочевина – (NH2) 2CO:
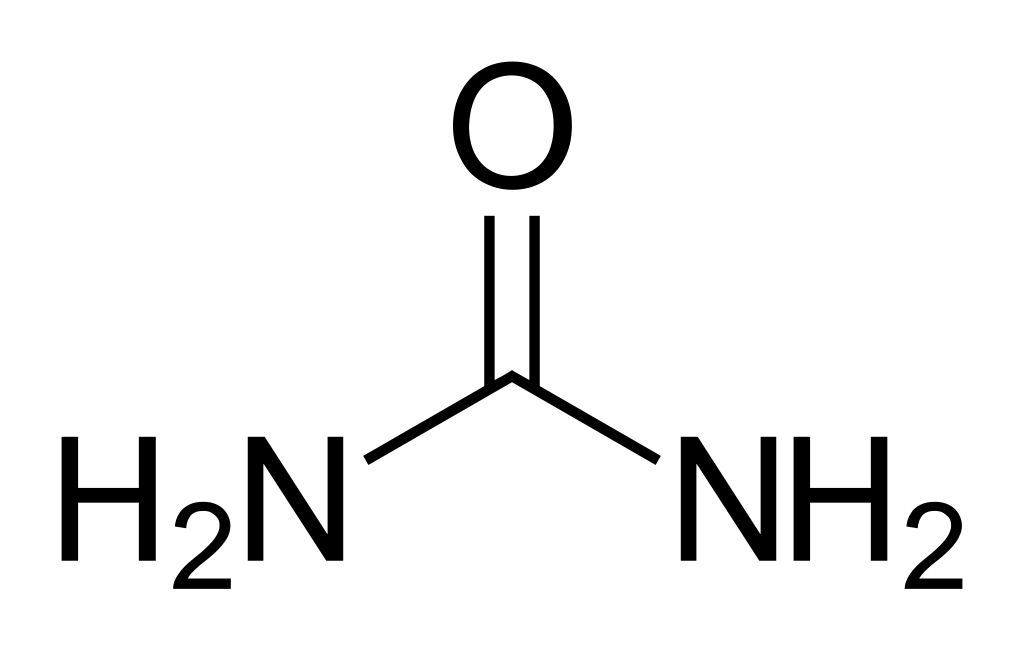
и карбаминовая кислота – CO(NH2)OH:
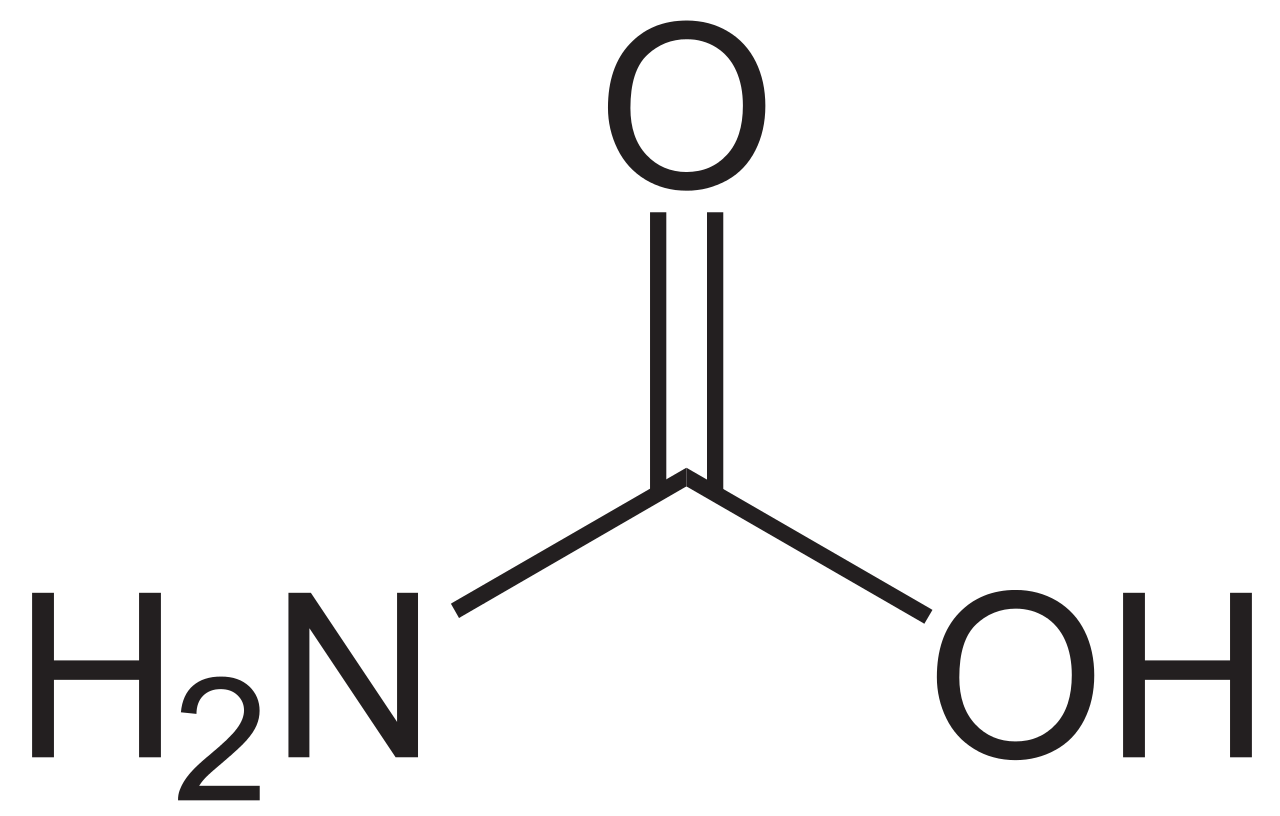
В неорганической химии мочевина используется как лиганд, а в сельском хозяйстве – как высокоэффективное азотное удобрение. Карбаминовая кислота и карбомат-ион могут также могут выступать как комплектующие реагенты за счет неподеленных электронных пар на атомах азота и кислорода.
В аналитической химии для осаждения катионов щелочноземельных металлов Ca2+, Sr2+, Ba2+ применяют раствор карбоната аммония (NH2)2CO3.